Pernahkah kalian menanak nasi? Menurut pendapatmu, peristiwa apa yang menyebabkan beras yang bertekstur keras dapat berubah menjadi nasi yang lunakdan lembut? Tentu hal ini terjadi karena adanya perpindahan kalor dari api kompor ke beras dan air yang berada dalam wadah pemasak itu. Bagaimanakah cara kalor berpindah? Ada tiga cara perpindahan kalor, yaitu konduksi, konveksi, dan radiasi.
1. Konduksi
Proses perpindahan kalor melalui suatu zat tanpa diikuti perpindahan bagian-bagian zat itu disebut konduksi atau hantaran. Misalnya, salah satu ujung batang besi kita panaskan. Akibatnya, ujung besi yang lain akan terasa panas.
Coba perhatikan gambar berikut:

Pada batang besi yang dipanaskan, kalor berpindah dari bagian yang panas ke bagian yang dingin. Jadi, syarat terjadinya konduksi kalor pada suatu zat adalah adanya perbedaan suhu. Berdasarkan kemampuan menghantarkan kalor, zat dapat dikelompokkan menjadi dua golongan, yaitu konduktor dan isolator. Konduktor adalah zat yang mudah menghantarkan kalor (penghantar yang baik). Isolator adalah zat yang sulit menghantarkan kalor (penghantar yang buruk).
2. Konveksi
Proses perpindahan kalor melalui suatu zat yang disertai dengan perpindahan bagian-bagian yang dilaluinya disebut konveksi atau aliran. Konveksi dapat terjadi pada zat cair dan gas.
a. Konveksi pada Zat Cair
Syarat terjadinya konveksi padaz at cair adalah adanya pemanasan. Hal ini disebabkan partikel-partikel zat cair ikut berpindah tempat.
b. Konveksi pada Gas
Konveksi terjadi pula pada gas, misalnya udara. Seperti halnya pada air, rambatan (aliran) kalor dalam gas (udara) terjadi dengan cara konveksi. Beberapa peristiwa yang terjadi akibat adanya konveksi udara adalah sebagai berikut.
1) Adanya angin laut. Angin laut terjadi pada siang hari. Pada siang hari, daratan lebih cepat menjadi panas daripada lautan sehingga udara di daratan naik dan digantikan oleh udara dari lautan.2). Adanya angin darat, Angin darat terjadi pada malam hari. Pada malam hari, daratan lebih cepat menjadi dingin daripada lautan. Dengan demikian, udara di atas lautan naik dan digantikan oleh udara dari daratan.
4) Adanya cerobong asap pabrik.
3. Radiasi
Proses perpindahan kalor tanpa zat perantara disebut radiasi atau pancaran. Kalor diradiasikan dalam bentuk gelombang elektromagnetik, gelombang radio, atau gelombang cahaya. Misalnya, radiasi panas dari api Apabila kita berdiam di dekat api unggun, kita merasa hangat. Kemudian, jika kita memasang selembar tirai di antara api dan kita, radiasi kalor akan lerhalang oleh tirai itu. Dengan demikian, kita dapat mengatakan bahwa:
Kalor dari api unggun atau matahari dapat dihalangi oleh tabir sehingga kalor tidak dapat merambat. Ada beberapa benda yang dapat menyerap radiasi kalor atau menghalanginya. Alat yang digunakan untuk mengetahui atau menyelidiki adanya radiasi disebut termoskop, seperti yang tampak pada gambar berikut:
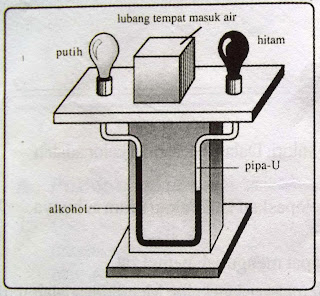
Dari hasil penyelidikan dengan menggunakan termoskop, kita dapat mengetahui bahwa:
1) Permukaan yang hitam dan kusam adalah penyerap atau permancar radiasi kalor yang baik.2) Permukaan yang putih dan mengkilap adalah penyerap atau pemancar radiasi yang buiruk.
4. Mencegah Perpindahan Energi Kalor
Energi kalor dapat dicegah untuk berpindah dengan mengisolasi ruang tersebut. Misalnya, pada penerapan beberapa peralatan rumah tangga, seperti termos dan setrika listrik.
Mengapa permukaan di dalam botol termos mengilap? Dindinnya berlapis dua ruang di antara kedua dinding itu dihampakan. Dengm demikian, zat cair yang ada di dalamnya tetap panas untuk waktu yang relatif lama. Termos dapat mencegah perpindahan kalor, baik secara konduksi, konveksi, maupun radiasi.
b. Setrika Listrik
Mengapa pakaian yang disetrika menjadi halus atau tidak kusut? Di dalam setrika listrik terdapat filamen dari bahan nikelin yang berbentuk kumparan. Kurnparan nikelin ini ditempatkan pada dudukan besi. Ketika listrik mengalir, filamen setrika listrik menjadi panas. Panas ini dikonduksikan pada dudukan besi dan akhirnya dikonduksikan pada pakaian yang disetrika. Dengan demikian, setrika mengkonduksi kalorpada pakaian yang disetrika.
SUMBER : http://memetmulyadi.blogspot.com












