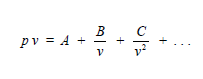SISTEM DAN PERSAMAAN
KEADAAN SISTEM
A.
Keadaan Kesetimbangan Sistem dan Persamaan Keadaannya
Suatu sistem dapat berada dalam keadaan setimbang atau tidak
setimbang. Ada empat keadaan setimbang suatu sistem. Keempat keadaan setimbang
tersebut adalah:
1. keadaan setimbang mekanis
2. keadaan setimbang kimiawi (chemis / kemis)
3. keadaan setimbang termal / termis
4. keadaan setimbang termodinamis.
1. Keadaan Setimbang Mekanis
Suatu sistem dinyatakan berada dalam keadaan setimbang mekanis
jika resultan gaya luar maupun resultan gaya dalamnya (gaya dachil) adalah nol.
Ini berarti
Σ=0F
Dalam keadaan setimbang mekanis, suatu sistem dapat diam atau
bergerak beraturan. Dalam arti bergerak lurus beraturan atau bergerak melingkar
beraturan atau berotasi beraturan.
2. Keadaan Setimbang Kemis
Apabila suatu sistem
a. tidak mengalami
perpindahan zat dari bagian satu ke bagian lainnya atau sistem tidak mengalami
difusi
b. tidak terjadi reaksi
kimiawi yang dapat mengubah jumlah partikel semula
c. tidak terjadi pelarutan
d. tidak terjadi kondensasi
serta
e. komposisi dan
konsentrasinya tetap,
maka sistem itu berada
dalam keadaan setimbang kemis (kimiawi). Ini berarti sistem dinyatakan
setimbang kemis (kimiawi), jika sistem tidak berubah dan tetap berada dalam
keadaan semula.
3. Keadaan Setimbang Termis
Apabila suatu sistem :
a. koordinat makro maupun
mikronya tidak berubah walaupun kontak termal dengan lingkungannya melalui
dinding diatermik
b. harga koordinat makro
maupun mikronya tidak berubah dengan perubahan waktu,
maka sistem berada dalam keadaan setimbang
termis dengan lingkungannya. Oleh karena itu, suatu sistem disebut setimbang
termis, jika harga koordinatnya tidak berubah dengan perubahan waktu.
4. Keadaan Setimbang
Termodinamis
Apabila syarat-syarat
kesetimbangan mekanis, kemis, dan termis terpenuhi, maka sistem berada dalam
keadaan setimbang termodinamis. Dalam keadaan setimbang termodinamis, keadaan
koordinat sistem maupun lingkungan sistem cenderung tidak berubah sepanjang
masa. Jadi, pada dasarnya Termodinamika hanya mempelajari suatu sistem yang
berada dalam kesetimbangan termodinamis.
Keadaan sistem yang
setimbang termodinamis minimal ada dua, yaitu: sistem yang tertutup dan sistem
yang terbuka. Suatu sistem dinyatakan tertutup, jika massa dan jumlah partikel
sistem tetap. Ini berati, jumlah mol sistem yang tertutup selalu tetap.
Sebaliknya, sistem
dinyatakan terbuka, jika massa dan jumlah partikel sistem berubah-ubah
harganya. Ini berarti, jumlah mol sistem yang terbuka selalu berubah-ubah.
Dalam keadaan setimbang
termodinamis, ternyata
a. setiap sistem tertutup
dapat digambarkan oleh tiga koordinat sistem dari delapan koordinat yang
dipunyainya
b. semua eksperimen
menunjukkan bahwa antara ketiga koordinat itu terdapat hubungan berikut.
f (x, y, z) = 0
Ini berarti, dalam keadaan setimbang termodinamis, hanya dua
diantara ketiga koordinat sistem yang merupakan variabel (ubahan) bebas.
Pernyataan ini dapat dituliskan seperti persamaan berikut :
X = f(y,z)
Y = f(x,z)
Z = f(x,y)
Gas
berada dalam silinder dengan koordinat sistem, G (energi bebas Gibbs
dari gasa), p (tekanan gas), H (entalpi gas), S (entropi
gas), U (energi dalam gas), V (volume gas), F (energi
bebas Helmholtz), dan T (temperatur gas). Perhatikan tiga koordinatnya,
misalnya: p, V, dan T. Andaikan V dan T ditentukan
terlebih dulu secara bebas, misalnya: gas dimasukkan dalam silinder dengan
volume V dan dipanasi sampai temperaturnya mencapai harga T, maka
tekanan gas telah memiliki harga tertentu dan tidak dapat ditentukan secara
bebas. Ini berarti:
P = F (V,T)
Andaikan
p dan T ditentukan terlebih dulu secara bebas, misalnya: gas
dimasukkan dalam silinder dengan tekanan p dan dipanasi sampai
temperaturnya mencapai harga T, maka volume gas telah memiliki harga
tertentu dan tidak dapat ditentukan secara bebas. Ini berarti
V = f (p,T)
Andaikan
p dan V ditentukan terlebih dulu secara bebas, misalnya: gas
dimasukkan dalam silinder dengan tekanan p dan ditekan sampai volumenya
mencapai harga V, maka temperatur gas telah memiliki harga tertentu dan
tidak dapat ditentukan secara bebas. Ini berarti:
T = f(p,V)
Dengan
demikian, secara umum berlaku persamaan:
f(p,V.T) = 0
Persamaan diatas merupakan persamaan keadaan gas
atau persamaan keadaan sistem yang berada dalam keadaan setimbang termodinamis.
B. Persamaan Keadaan Sistem
Ada beberapa sistem termodinamis
(suatu sistem yang berada dalam keadaan setimbang termodinamis), yaitu:
1.Sistem Hidrostatis
(Hidrostatik) atau Sistem Kemis (Kimiawi)
2. Sistem Paramagnetis
(Paramagnetik).
3. Sistem Dielektris
(Dielektrik).
4. Sistem Dawai yang
Teregang.
5. Sistem Selaput Tipis.
6. Sistem Sel Listrik.
1. Sistem Hidrostatis
Sistem hidrostatis
merupakan zat kimia yang tidak diperhatikan sifat kelistrikannya,
kemagnetannya, elastisitasnya, dan sifat tegangan permukaannnya. Sistem
hidrostatis ada dua, yaitu: zat murni dan zat tak murni. Contoh sistem
hidrostatis adalah: gas, cairan, atau padatan.
Sistem hidrostatis disebut
zat murni apabila terdiri atas satu senyawa kimia saja dan berada dalam keadaan
setimbang termodinamis. Misalnya: Es (H2O), Air (H2O), Uap Air (H2O), Karbondioksida (CO2), Hidrogen (H2), Nitrogen (N2), atau Oksigen (O2). Karbondioksida, hidrogen, nitrogen, dan
oksigen dapat berada dalam wujud padatan, gas, maupun cairan.
Sistem hidrostatis disebut
zat tak murni apabila terdiri atas campuran zat murni yang berada dalam keadaan
setimbang termodinamis. Misalnya: udara yang terdiri dari campuran oksigen,
nitrogen, uap air, dan karbondioksida. Dalam udara masih ada beberapa jenis gas
lagi, namun jumlahnya sedikit sekali, misalnya gas argon, helium, neon, dan gas
kripton.
Persamaan keadaan sistem
hidrostatis dinyatakan dalam fungsi
f(p,V.T) = 0
a. Gas Ideal, dengan persamaan keadaan: p V = n R T
b. Gas Clausius, dengan persamaan kedaan: p
(v – b) = R T
c. Gas van
der Waals, dengan persamaan keadaan
Dalam bentuk lain persamaan
keadaan gas van der Waals dapat ditulis sebagai berikut.
p v2 – (p b + R T) v2 + a v
– a b = 0
d. Persamaan keadaan gas real sebagai
berikut.
A, B, C, dan seterusnya disebut sebagai koefisien virial yang merupakan
fungsi temperatur. Karena persamaan 3.8.b sama dengan persamaan 3.9, maka
diperoleh:
A = R T, B = R T b, C = R T
b2,
demikian selanjutnya
2. Sistem Paramagnetik
Sistem paramagnetik merupakan gas, cairan,
padatan, atau campuran dari dua atau tiga wujud tersebut yang memiliki kuat
medan magnet luar yang disebut induksi magnetik (B) yang
mempengaruhi kemagnetan atom-atom atau magnetisasi (M). Sedangkan
temperatur sistem paramagnetik mempengaruhi orientasi atom-atom sistem
paramagnetik dan orientasi atom-atom ini akhirnya mempengaruhi magnetisasi.
Jadi sistem paramagnetik minimal mempunyai tiga
koordinat sistem, yaitu: induksi magnetik luar (B), Magnetisasi (M),
dan temperatur sistem paramagnetik (T). Sedangkan contoh sistem
paramagnetik misalnya: Aluminum (Al), Calcium (Ca), Magnesium (Mg), dan
Chromium (Cr).
Untuk jelasnya, ditinjau sebuah kristal Mg yang
memiliki banyak atom, misalnya sebanyak m buah atom. Andaikan kristal
ini dibiarkan begitu saja, maka kristal tetap dalam kondisi netral. Jika
dipandang dari segi kemagnetannya, atom-atom Mg merupakan momen atau dipol
magnetik (μi))
yang tertentu, sehingga
dipol magnetik totalnya adalah:
Namun, karena arah dipol magnetik berbeda-beda
(berorientasi secara acak) sedemikian rupa, sehingga magnetisasinya tidak ada
atau sama dengan nol.
Atom-atom tidak terlihat mata, maka atom-atom
yang bersifat magnet atau dipol magnetik ini merupakan magnet-magnet kecil
sekali yang disebut magnet elementer. Karena arah magnet elementer berbeda-beda
sedemikian rupa, sehingga kemagnetan kristal Mg juga tidak tampak atau
kemagnetannya sama dengan nol, sehingga magnetisasinya juga sama dengan nol.
Pada hakikatnya momen magnetik atau dipol
magnetik bersumber pada elektron yang mengelilingi inti dalam kulit atau sub
kulit yang tidak penuh seluruhnya. Momen magnetik atom dinyatakan dalam satuan
yang disebut sebagai magneton Bohr, yaitu:
μB ≈ 9 x 10 – 24 A m2
Andaikan sistem
paramagnetik yang berupa kristal Mg diperlakukan, misalnya diberi medan magnet
luar yang kuat dengan induksi magnetik B, maka dipol magnetik
atau magnet elementer arahnya akan terorientasi searah dengan medan magnet
luar. Dengan demikian, sistem paramagnetik memiliki suatu besaran atau
koordinat yang menyatakan kuat medan magnet luar yang disebut induksi magnetik B.
Tanpa medan magnet luar, sepotong kristal
paramagnetik tidak memiliki apa yang dinamakan kemagnetan atau magnetisasi M,
karena masing-masing magnet elementer atau dipol magnetik berorientasi acak.
Karena ada medan magnet luar, maka magnet elementer atau dipol magnetik
terorientasi searah dengan arah medan magnet luar. Boleh dinyatakan,
magnet-magnet elementer atau dipol magnetik akan berusaha menyejajarkan
(menjajarkan) diri dengan medan magnet luar. Dengan demikian magnetisasi M
merupakan koordinat kedua sistem paramagnetik.
Koordinat ketiga sistem paramagnetik adalah
temperatur (T). Mengapa demikian ? Karena penyejajaran (penjajaran)
magnet elementer atau dipol magnetik (μi) oleh kuat medan magnet luar dengan induksi
magnetik B ditentang oleh temperatur (T). Maksudnya,
karena atom-atom dalam suatu kristal senantiasa bergetar, sedangkan kenaikan
temperatur menyebabkan getaran semakin hebat, maka semakin tinggi temperatur
semakin acak orientasi magnet elementer atau dipol magnetiknya, sehingga
magnetisasinya (M) semakin kecil.
3. Teori Langevin dan Teori Brillouin
Perhatikan 2 gambar dibawah. Gambar pertama
menunjukkan lukisan sebuah sistem paramagnetik atau sebuah kristal Mg dengan
magnet elementer atau dipol magnetik (μi) yang arahnya acak tak keruan. Akibatnya apa ?
Akibatnya kristal Mg tidak memiliki kemagnetan atau magnetisasi (M).
Dengan demikian dapat dituliskan:
Jika magnetisasi didefinisikan
sebagai dipol magnetik total per satuan volume, maka dapat dituliskan persamaan
magnetisasi sebagai berikut.
Gambar kedua
melukiskan sebuah kristal Mg yang berada dalam medan magnet luar dengan induksi
magnetik B. Akibatnya apa ? Akibatnya, magnet elementer atau
dipol magnetik terorientasi searah dengan arah kuat medan magnet luar, sehingga
μ ≠ 0 dan
Berapa energi sistem
paramagnetik ? Energi sistem paramagnetik E menggambarkan interaksi
antara induksi magnetik kuat medan magnet luar B dan induksi
magnetik total magnet elementer atau dipol magnetik μ. Energi sistem paramagnetik E didefinisikan
sebagai minus perkalian skalar μ dan B yang
dapat ditulis sebagai berikut.
Pada saat B sejajar
dan searah dengan μ, maka sudut θ = 00, sehingga cos θ = 1 dan energi sistem paramagnetik dapat
ditulis sebagai E = - μ B yang sering ditulis
sebagai Eparalel
= Epar = - μ B. Pada saat B sejajar
dan berlawanan arah dengan μ, maka sudut θ = 1800, sehingga cos θ = - 1 dan energi sistem paramagnetik dapat
ditulis sebagai E = + μ B yang sering ditulis
sebagai Eanti
paralel = Eap = + μ B. Pada saat B tegak lurus
dengan μ, maka sudut θ = 900, sehingga cos θ = 0 dan energi sistem paramagnetik E =
0 yang sering ditulis sebagai E┴ = 0. Jika hasil ini digambar, diperoleh
gambar berikut :
Teori mengenai magnetisasi sistem paramagnetik telah dikemukakan
satu abad yang lalu. Teori yang pertama dikemukakan oleh Langevin (baca
Longevan) pada tahun 1905 yang menghasilkan persamaan keadaan berikut.
dengan n adalah
jumlah dipol magnetik (N) per satuan volume (V) dan μ adalah dipol magnetik total dalam kristal
atau sistem paramagnetik
dengan :
B =
induksi magnetik dari kuat medan magnet luar
k = konstante Boltzmann
= 1,3806 x 10 –23 J K –1
T = temperatur sistem
paramagnetik
yang dikenal sebagai fungsi Langevin.
Dengan mensubstitusikan persamaan diatas, maka
diperoleh :
Jika dihitung harga limit dari persamaan 3.19 pada dua kasus yang
ekstrem, yaitu:
a.apabila kuat medan magnet luar sangat kuat dan
temperatur
sistem paramagnetik sangat rendah, maka harga
sangat besar
b. apabila kuat medan magnet luar sangat lemah
dan temperatur sistem paramagnetik sangat tinggi, maka harga sangat kecil
Ketika x >> 1, maka coth x ≈
1 dan dapat diabaikan, sehingga diperoleh persamaan: x1
M = μn
Persamaan tersebut menunjukkan, bahwa magnetisasi M mengalami
kejenuhan sebagai hasil apabila semua molekul / atom-atom / magnet elementer /
dipol magnetik sejajar dengan medan magnet luar.
Pada kuat medan magnet luar yang sangat kecil
dan temperatur sistem paramagnetik sangat besar, maka x << 1 dan
kita dapat menggunakan pendekatan untuk coth pada sebuah sudut yang kecil,
sehingga diperoleh persamaan
maka didapat
Dengan :
C = konstante Curie =  = 0,376 cm3 K mole–1 dan
persamaan ini disebut sebagai hukum
Curie.
= 0,376 cm3 K mole–1 dan
persamaan ini disebut sebagai hukum
Curie.
Grafik fungsi Langevin dapat dilukiskan seperti
gambar berikut
sumber : HAMID, AHMAD ABU. 2007. DIKTAT PERKULIAHAN TERMODINAMIKA : KALOR DAN TERMODINAMIKA. YOGYAKARTA : FMIPA UNY.